الصيغة الكيميائية تحدد عدد ذرات العناصر المرتبطة
نعم الصيغة الكيميائية تحدد عدد ذرات العناصر المرتبطة، حيث أن الكيمياء تتواجد في كل مكان في الطبيعة وفي جميع الكائنات الحية، وبشكل عام تتكون جميع الكائنات الحية في الأصل من مواد كيميائية، وتتعرض دائمًا للتفاعل الكيميائي التغير الكيميائي الصيغة الكيميائية تحدد عدد ذرات العناصر المرتبطة سواء كان داخل أجسامها أو في العمليات الحيوية التي تقوم بها مثل عملية البناء الضوئي والهضم وما إلى ذلك، تتكون جميع المواد الكيميائية من عناصر وتلك العناصر يكون لها صيغ كيميائية حيث أن الصيغة الكيميائية تحدد عدد ذرات العناصر المرتبطة.الصيغة الكيميائية تحدد عدد ذرات العناصر المرتبطة
الصيغة الكيميائية لجميع الجزيئات
الصيغة الكيميائية هي عبارة عن صيغة تحدد عدد ذرات عنصر معين أو مجموعة
من العناصر المتعددة، والتي تتواجد داخل المركبات الكيميائية، حيث يتم استخدام الأرقام
التي تظهر كرموز داخل الصيغة الكيميائية والتي تُمثل عدد الذرات الموجودة
داخل المادة الكيميائية، فعلى سبيل المثال الصيغة الكيميائية للماء هو H2O،
حيث يعبر الرمز السفلي وهو الهيدروجين وهو اثنان وذلك يعني أنه يوجد ذرتين
من الهيدروجين موجودتين في الماء، بينما تفتقر ذرة الأكسجين إلى جزء منخفض
من الأعداد حيث توجد ذرة واحدة فقط من الأكسجين في الصيغة الكيميائية للماء.
وبشكل عام يُشير المركب الكيميائي إلى المادة الكيميائية التي تحتوي على ذرات متكونة
وبشكل عام يُشير المركب الكيميائي إلى المادة الكيميائية التي تحتوي على ذرات متكونة
من عنصرين مختلفين على الأقل، فتحتوي الجزيئات مثل المركبات الكيميائية
على عدد كبير من الذرات المتعددة، وسوف نلاحظ أن ذلك على عكس المركبات الكيميائية،
حيث أنه من الممكن أن يتكون الجزيء بكل بساطة من ذرات لها نفس العنصر،
وليكن على سبيل المثال الماء التي نجد من خلالها أن نوع الجزيئات
يتكون من ذرتين هيدروجين وذرة أكسجين واحدة، أو جزيء الهيدروجين ثنائي الذرة
{eq} H_ {2} {/ eq} ، والذي يتكون من ذرتين هيدروجين مرتبطين معًا.
وبذلك يمكن أن نُعرف الصيغة الكيميائية على أنها عبارة عن تدوين يقوم العلماء
وبذلك يمكن أن نُعرف الصيغة الكيميائية على أنها عبارة عن تدوين يقوم العلماء
باستخدامه من أجل إظهار عدد ونوع الذرات الموجودة في الجزيء، ويحدث ذلك
باستخدام الرموز الذرية والرموز العددية الموجودة بجانب العنصر الكيميائي،
وبالتالي تكون الصيغة الكيميائية عبارة عن تمثيل بسيط لكتابة جزيء ثلاثي الأبعاد موجود،
حيث تقوم الصيغة الكيميائية بوصف مادة ما، حتى تصل في النهاية
أمثلة على الصيغة الكيميائية
هناك الكثير من الأمثلة على الصيغ الكيميائية للعناصر والمركبات المختلفة،
والتي من المهم التعرف عليها ودراستها حيث أن الصيغة الكيميائية تحدد عدد ذرات
العناصر المرتبطة، يتم دراسة الصيغ الكيميائية لطلاب المرحلة الثانوية والجامعات
العلمية حيث يتم دراسة الكثير من المركبات من أجل معرفة التكافؤات اللازمة
لكل مركب
وإليك بعض الأمثلة على الصيغ الكيميائية وإليك هي:
- حمض الأسكوربيك أو فيتامين ج {eq} C_ {6} H_ {8} O_ {6} {/ eq}.
- حمض أستيتيك أو الخل {eq} C_ {2} H_ {4} O_ {2} {/ eq}.
- الجلوكوز {eq} C_ {6} H_ {12} O_ {6} {/ eq}.
- حمض الفوسفوريك {مكافئ} H_ {3} PO_ {4}.
- كلوريد الصوديوم (ملح الطعام)
- غاز الميثان {مكافئ} CH_ {4} ).
- البروبان {مكافئ} C_ {3} H_ {8}.
- أوكتان {مكافئ} C_ {8} H_ {18}.
- الأمونيا {eq} NH_ {3} {/ eq}.
- كلوريد الفضة AgCl.
تعريف الصيغة الجزيئية
الصيغة الجزيئية نوع من أنواع الصيغة الكيميائية التي تعمل
على استخدام رموز العناصر الكيميائية الموجودة في الجدول الدوري،
فتعمل الصيغة الجزيئية على إظهار العدد الفعلي للذرات داخل كل جزيء وغالبًا
ما يتم استخدام مصطلح الصيغة الكيميائية والصيغة الجزيئية بالتبادل، فيتم كتابة
الصيغة الجزيئية للماء بهذا الشكل {eq} H_ {2} O {/ eq}، وهو متشابهة تمامًا
يُمثل أن جزيء الماء يتكون من ذرتين من الهيدروجين،
وذلك كما ذكرنا سابقًا في هذا المقال.
بينما في حالة الصيغة الجزيئية لعنصر الألمونيوم سوف نلاحظ أنه تم كتابة الرقم الثاني
وذلك كما ذكرنا سابقًا في هذا المقال.
بينما في حالة الصيغة الجزيئية لعنصر الألمونيوم سوف نلاحظ أنه تم كتابة الرقم الثاني
على هيئة رمز منخفض يُمثل في الأصل أن جزيء الماء يتكون من ذرتين من
الهيدروجين أيضًا، فنلاحظ أيضًا أن الصيغة الجزيئية لمركب بيروكسيد الهيدروجين
هي H 2 O 2، وتلك الصيغة من الصيغ المركبة نسبًا إلى الهيكل الفعلي
على ذرتين من عنصر الأكسجين المرتبطة ببعضها البعض في الوسط، وبتلك الطريقة
تكون الصيغة الجزيئية لا توضح كافة المعلومات حول تركيب العناصر على الإطلاق،
ومع ذلك سوف نجد أنه غالبًا ما تُستخدم الصيغة الجزيئية من أجل وصف الجزيئات
ويرجع ذلك ببساطة إلى كونها مريحة ويمكن البحث عن معظم الجزيئات
بعد تحديد صيغتها بشكل صحيح.
أنواع الصيغ الكيميائية
- الصيغة المكثفة.
- والهيكلية.
- التجريبية.
- والجزيئية (تم التحدث عنها مسبقًا)
يوجد ثلاث أنواع رئيسية من الصيغة الكيميائية وهي الصيغة التجريبة والصيغة
البنائية والصيغة الجزيئية وهي التي عادًة ما يتم المقارنة بينها وبين الصيغة الكيميائية
العادية، حيث تعمل كل واحدة من تلك الصيغ الكيميائية على رصد معلومات مختلفة
عن تكوين المادة، كما أنها تدل على الشكل ثلاثي الأبعاد،
وتُعرفنا على كيفية تفاعلها مع الجزيئات والذرات والأيونات الأخرى.
حيث أنه في الصيغة الكيميائية، تُمثل الحروف الرمز الذري لكل ذرة، حيث يُمثل الحرف
حيث أنه في الصيغة الكيميائية، تُمثل الحروف الرمز الذري لكل ذرة، حيث يُمثل الحرف
السفلي عدد كل ذرة، بينما يُمثل الحرف العلوي الشحنة الموجودة على كل ذرة،
بينما يُمثل المعامل الموجود قبل الصيغة الكيميائية عدد من وحدات الجزيء،
وبصفة عامة يتم قراءة كل نوع من الأنواع المختلفة للصيغ الكيميائية بشكل مختلف
عن الآخر، وهناك أربعة أنواع شائعة في علم الكيمياء وتلك الأنواع عبارة عن أنواع مندرجة
من الصيغة الكيميائية العامة
وفيما يلي سوف نتعرف على تلك الأنواع وإليك هي:
صيغة مكثفة: هي عبارة عن نوع من الصيغ الكيميائية التي تحتوي على رموز الذرات
صيغة مكثفة: هي عبارة عن نوع من الصيغ الكيميائية التي تحتوي على رموز الذرات
بالترتيب كما يُشار إلى الصيغة المكثفة أيضًا باسم الصيغة البنائية المكثفة،
حيث أن الصيغة المكثفة تُشبه الصيغة البنائية، باختلاف أن الصيغة المكثفة تتجاهل
مقاطع الخط التي ترمز إلى الروابط بين الذرات، فعلى سبيل المثال الصيغة المكثفة
للبروبان {eq} CH_ {3} CH_ {2} CH_ {3} {/ eq}.
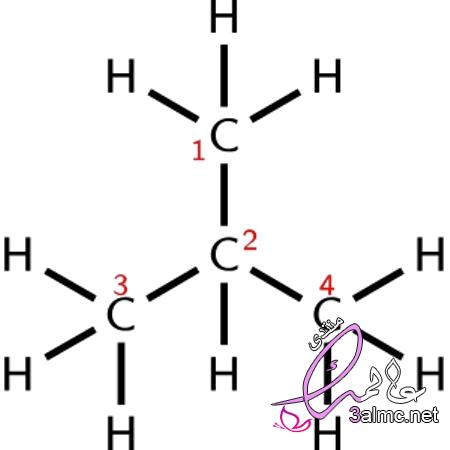
الصيغة الهيكلية: الصيغة الهيكلية للجزيء هي نفسها الصيغة البنائية للجزيء وتعتبر
الصيغة الهيكلية: الصيغة الهيكلية للجزيء هي نفسها الصيغة البنائية للجزيء وتعتبر
من الصيغ الكيميائية ذات اللمسات الفنية، حيث يتم فيها عرض الروابط الفعلية
بين الجزيئات، مما يعمل على مساعدة القارئ على فهم كيفية ارتباط الذرات
المختلفة ببعضها، وبالتالي كيفية عمل الجزيء في الفضاء، كما أنه هناك الكثير
من الصيغ الكيميائية التركيبية المختلفة التي يجب مراعاتها.
وتعتبر أبسط طريقة يمكن بها معرفة الصيغة الهيكلية هي طريقة النقط الإلكترونية،
وتعتبر أبسط طريقة يمكن بها معرفة الصيغة الهيكلية هي طريقة النقط الإلكترونية،
حيث يتم استخدام النقطتين والفترات من أجل إظهار الروابط بين الذرات،
حيث يُمثل كل القولون زوج من الإلكترونات، مشتركة بين الذرات على جانبي القولون
كما تُمثل هذه الصيغة بدقة أكبر الترتيب الفعلي للذرات داخل الجزيء.
الصيغة التجريبية: تُمثل الصيغة الكيميائية التجريبية العدد النسبي لذرات كل عنصر
الصيغة التجريبية: تُمثل الصيغة الكيميائية التجريبية العدد النسبي لذرات كل عنصر
في المركب الكيميائي، حيث أن يوجد بعض المركبات مثل الماء يكون لها نفس الصيغة التجريبية والجزيئية، ويرجع ذلك إلى كونها صغيرة جدًا ولها نفس نسبة الذرات
في الجزيئات كما أن لها أيضًا نفس عدد الذرات في الجزيء،
وفيما يلي سوف نتعرف على الصيغة التجريبية والجزيئية للماء وإليك هي:
H 2 O: يتم تحديد الصيغة التجريبية لجزيء الماء من خلال وزن كل ذرة داخل الجزيء،
H 2 O: يتم تحديد الصيغة التجريبية لجزيء الماء من خلال وزن كل ذرة داخل الجزيء،
وبذلك في حالة وجود جزيء كبير مثل بيروكسيد الهيدروجين
سوف تكون الصيغة التجريبية له توضح فقط نسبة الذرات.
HO: تعمل الصيغة التجريبية الكيميائية على إظهار الأساس الرئيسي للجزيء فقط،
HO: تعمل الصيغة التجريبية الكيميائية على إظهار الأساس الرئيسي للجزيء فقط،
أي H O عبارة عن جزئين يجتمعان معًا لتشكيل جزيء بيروكسيد الهيدروجين.
المراجع
↑ https://3almc.com/different-ways-to-say
المراجع
↑ https://3almc.com/different-ways-to-say